

醫學實驗室通過ISO15189認可建立檢測質量及技術管理體系,提高實驗室質量管理水平,從而及時向患者和醫護人員提供準確的檢驗結果,并指導多方面的運作。通過ISO15189認可可提高醫學實驗室質量管理水平。新標準以風險管理為基礎,以患者為中心,鼓勵醫學實驗室持續改進。在標準文件的要求中,處處體現確保患者風險是醫學實驗室質量管理設計和流程核心的精神。

?新標準編寫框架上與修訂后的ISO9001:2015一致,遵循了類似結構,并在附件中與ISO9001:2015進行了比較。
?章節結構方面由原來的5章改為8章。
?納入新的引用文件涉及安全、風險、MU、溯源、EQA、RM、POCT等。
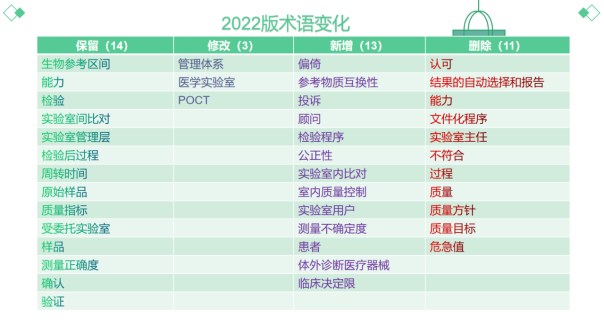
?術語方面保留了14個術語,修改3個,新增13個,刪除了11個。
?通用要求更加具體并強化。
?結構和管理要求中取消了“質量主管”的稱謂;不再要求必須編制“質量手冊;強調“風險管理”相關要求。
?資源要求方面區分了設備校準和項目校準;將床旁檢驗(POCT)納入了標準
?過程要求增加了“連續性和應急準備計劃”條款,針對實驗室遇到緊急情況時的措施和要求,以確保實驗室能夠恢復正常工作
?通過策劃和實施應對風險的措施,強化對患者福利的關注,最終目的是保證患者的健康和安全。

與ISO15189∶2012相比,ISO 15189:2022的結構發生很大變化,除第1章范圍、第2章規范性引用文件和第3章術語定義外,其余章節條款均重新進行了編排。總章節從原來的五章改為八章。


?增加引用ISO 17511《體外診斷醫療器械 建立校準品、正確度控制物和人樣品賦值的計量學溯源性要求》及GB/T《醫學實驗室 樣品采集、運送、接收和處理的要求》(等同采用ISO/TS 20658);
?刪除原文件第2章中引用的GB 19781和WS 233;原第2章引用的CNAS-GL028刪除,修改為WS/T 807《臨床微生物培養、鑒定和藥敏檢測系統的性能驗證》
?刪除《病理科建設與管理指南(試行)》(衛辦醫政發〔2009〕31號)


通用要求更具體并強化

4.1公正性和4.2保密性作為ISO對合格評定類標準的固定格式要求,新版這兩項內容的要求更加具體并強化;
4.3與患者相關的要求專門明確了9項具體與患者診療相關的要求。
結構和管理要求方面加入風險管理

主要變化包括概述“實驗室主任”的職責而不再羅列具體要求;取消了“質量主管”的稱謂,但仍規定其相關職責;不再要求必須編制“質量手冊;強調“風險管理”相關要求,強化了風險管理在整理組織管理中的作用。
區分了設備校準和項目校準將床旁檢驗(POCT)納入了標準

資源要求方面將6.5.2設備和方法的計量學溯源和6.5.3測量結果的計量學溯源進行了區分,區分了設備校準和項目校準;服務協議方面納入了POCT的要求。原來的POCT是一個獨立的標準,但是新版修訂以后,POCT的要求直接納入到ISO15189的標準里。專業對由實驗室提供支持的POCT活動的協議進行了規定,并有多學科組織的POCT委員會管理此類服務協議。此外,新標準發布后,ISO 22870《醫學實驗室POCT的要求》將廢止。
過程要求

不再要求評估不符合的程度,室間質評要求增加包括POCT檢驗方法,對實驗室投訴更加具體明確,新增加“連續性和應急準備計劃”條款:
針對實驗室遇到緊急情況時的措施和計劃,以確保實驗室能夠恢復正常工作,包括:制定緊急情況的應對計劃;
向實驗室人員提供信息和培訓;
對實際的緊急情況進行響應;
采取措施防止或降低緊急情況的后果
管理體系要求中特別強調風險管理

標準中有5.6和8.5兩個單獨條款規定風險管理要求,有近20處提及風險管理相關要求,在5.6風險管理中強調“風險管理”相關要求,強化了風險管理在整體組織管理中的作用。新增8.5“風險和改進措施”條款,再次突出風險管理的要求,取消“預防措施”要素,相關要求融入風險評估過程。要求更具體明確,包括:風險和改進機會識別:
1)防止或降低不利影響和潛在故障;
2)利用機會改進;
3)確保管理體系達到預期結果;
4)降低患者照護風險;
5)達到試驗室目的和目標。
聲明:本文所用視頻、圖片、文字部分來源于互聯網,版權屬原作者所有。如涉及到版權問題,請及時和我們聯系,核實后協商處理或刪除。