

2014年12月15日,衛生部臨床檢驗中心發布2015年全國外周血胎兒染色體非整倍體(T21、T18和T13)高通量測序檢測室間質量評價通知,表示將于2015年度正式開展全國外周血胎兒染色體非整倍體(T21、T18和T13)高通量測序檢測室間質量評價。
室間質量評價也稱為能力驗證實驗(以下簡稱PT),是指多家實驗室分析同一標本并由外部獨立機構收集、反饋實驗室上報結果并評價實驗室操作的活動,通過實驗室間的比對判定實驗室的校準、檢測能力以及監控其持續能力。長期以來,PT一直是臨床實驗室和公共衛生實驗室質量保證的一個重要組成部分。
室間質評目的:提高實驗室外周血胎兒染色體非整倍體(T21、T18和T13)高通量測序檢測的質量
衛生部對全國外周血胎兒染色體非整倍體(T21、T18和T13)高通量測序檢測展開室間質量評價,主要目的是提高實驗室外周血胎兒染色體非整倍體(T21、T18和T13)高通量測序檢測的質量。通知原文如下:
“新一代高通量測序技術發展迅速,并已由實驗室研究進入到臨床檢測應用,如外周血胎兒染色體非整倍體(T21、T18和T13)檢測、胚胎植入前遺傳學診斷(PGD和胚胎植入前遺傳學篩查(PGS)等,其中外周血胎兒染色體非整倍體(T21、T18和T13)檢測目前已有國家食品藥品監督管理總局(CFDA)批準的儀器和試劑。為提高實驗室外周血胎兒染色體非整倍體(T21、T18和T13)高通量測序檢測的質量,衛生部臨床檢驗中心于2015年度正式開展全國外周血胎兒染色體非整倍體(T21、T18和T13)高通量測序檢測室間質量評價。”
2014室間質評結果:絕大多數結果符合預期
這并不是衛生部第一次發布全國外周血胎兒染色體非整倍體(T21、T18和T13)高通量測序檢測室間質量評價通知,2014年11月,為配合衛計委新一代高通量測序技術應用試點工作,衛生部臨床檢驗中心開展了該項目的全國室間質量評價活動,并要求各臨床實驗室使用日常所用試劑和程序進行檢測。以下是2014室間質評主要結果,數據來源于《全國外周血胎兒染色體非整倍體(T21、T18 和 T13)高通量測序檢測室間質量評價調查活動結果報告 》。
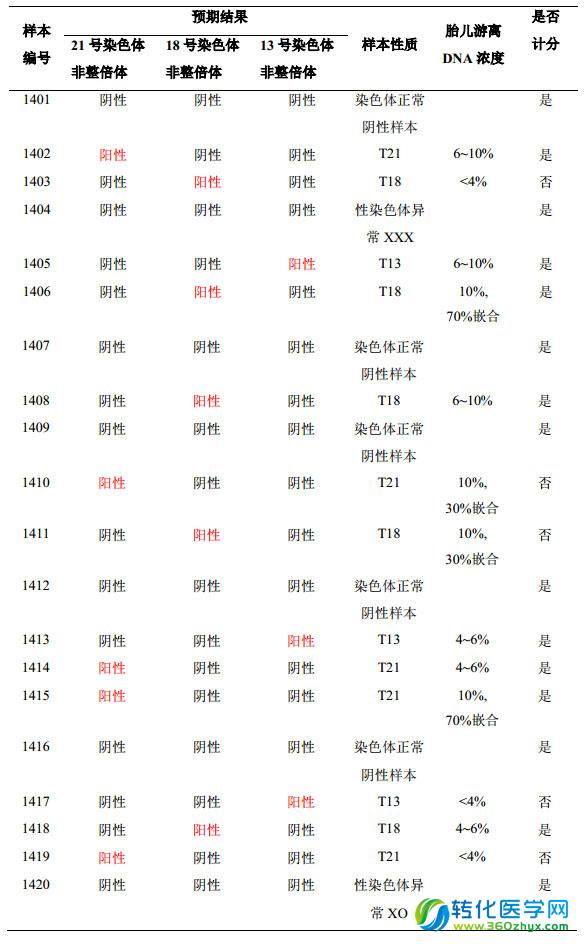
1、樣本情況
本次共發放 20 個質評樣本,編號分別為 1401、1402、1403、1404、1405、1406、1407、1408、1409、1410、1411、1412、1413、1414、1415、1416、1417、1418、1419、1420。樣本為人血漿,樣本量為 700µl。其中 15 份樣本用于本次PT 成績評價,5 份樣本用于正式質評發放樣本類型的參考,不納入本次 PT 成績評價。具體信息見下表。
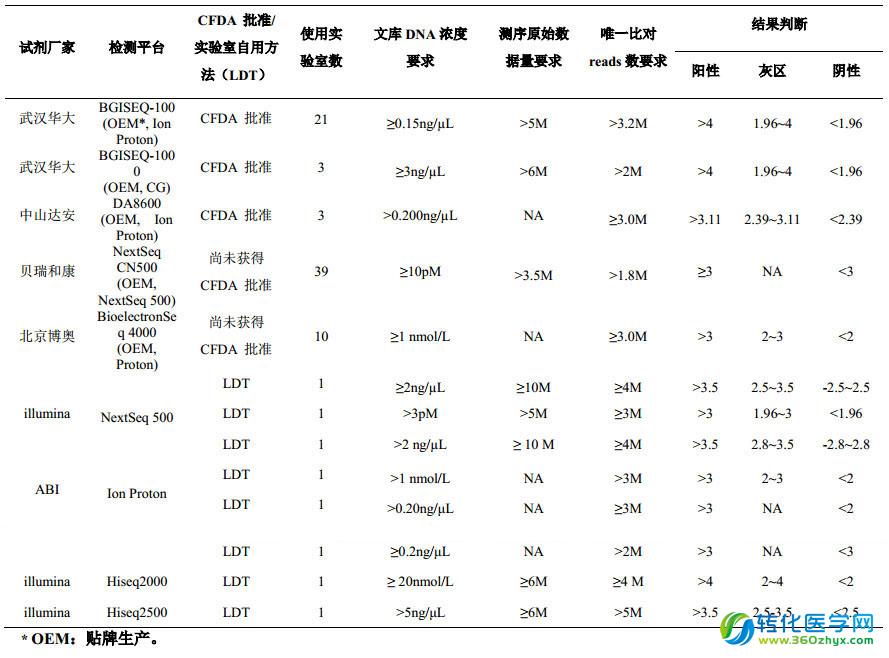
2、各檢測平臺使用的實驗室數及相關參數
本次質評涉及多個檢測平臺(由于 CFDA 為檢測儀器和配套試劑共同審批,因此本小結中所提及的檢測平臺,除 LDT 外,均同時代表該平臺及相應的配套試劑)。其中有醫療器械注冊證的檢測平臺:BGISEQ-100(武漢華大基因生物醫學工程有限公司),BGISEQ-1000(武漢華大基因生物醫學工程有限公司),DA8600(中山大學達安基因股份有限公司)等。其他檢測平臺有:NextSeq CN500,BioelectronSeq 4000,NextSeq 500,Ion Proton,Hiseq2000, Hiseq 2500,Ion torrent PGM。需要說明的是,沒有醫療器械注冊證的試劑和儀器,均屬實驗室自用方法(laboratory developed test,LDT),具體不同平臺的參數見下表。
3、實驗室回報結果情況
共計有 81 家實驗室回報質評結果,4 家實驗室報告了兩個平臺的檢測結果,共計收到結果 85 份,其中有效結果 84 份(即回報結果完整、在截止日期內回報的結果)。醫院臨床實驗室共計回報 73 份結果,獨立實驗室回報 12 份結果。總體來說,本次質評絕大多數實驗室的檢測結果均符合預期結果。在 15 份 PT 評價樣本中,98.8% (83/84)的實驗室與預期結果完全相符,只有 1 家實驗室兩份陽性樣本報告了“臨界/灰區”的結果,其余結果也均與預期結果相符,具體的總體結果回報情況見下表。
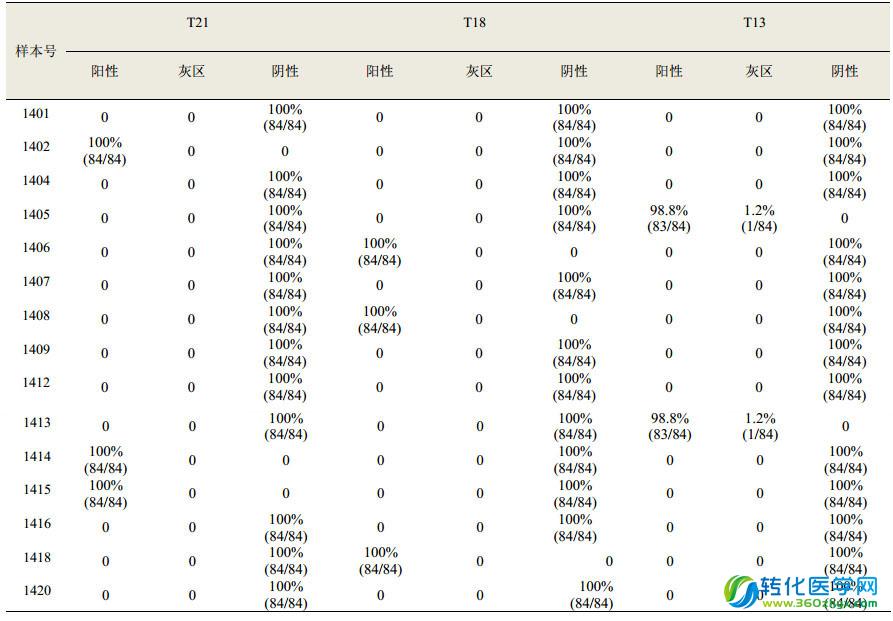
4、各檢測平臺不同樣本的符合率情況
一家使用 Hiseq 2500 的實驗室報告了 1405 和 1413 號樣本(預期結果為 T13 陽性)“臨界/灰區”的結果。其他平臺所有實驗室檢測結果均與預期結果相符,無假陰性和假陽性結果。
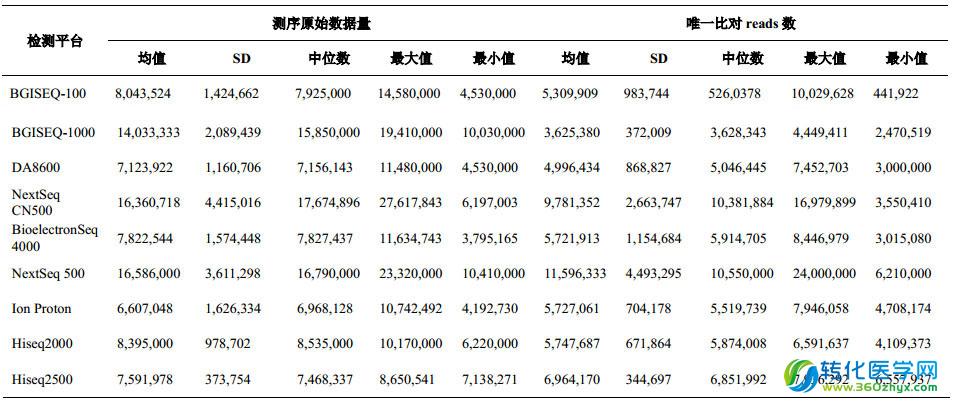
5、各檢測平臺對所有樣本檢測的測序原始數據量和唯一比對 reads 數情況
6、PT 成績情況
PT 成績≥80(即 80 和 100 分)的實驗室發放質評合格證書;PT 成績<80 分的實驗室和未回報完整定性結果的實驗室發放質評參加證書。本次質評中,PT成績為 100 分的實驗室 83 家,PT 成績在 80~100 分(含 80 分)的實驗室 1 家。1 家實驗室獲得質評參加證書。
對開展高通量測序 NIPT 臨床檢測實驗室的啟示
在2014室間質評的報告最后,衛計委指出:雖然各臨床實驗室的檢測結果良好,但基于本檢測項目在大多數實驗室均尚未對臨床開展,因此,在將來正式開展高通量測序 NIPT 臨床檢測中,仍需謹慎對待。
盡管目前商業化的平臺(包括 CFDA 批準或正在進行注冊的平臺)在生物信息學分析和結果判讀方面,進行了簡化,但是與以往臨床實驗室開展的核酸檢測項目相比,基于高通量測序的 NIPT 仍然是一個相對復雜的檢測過程。通常,NIPT 的檢測流程包括:DNA 提取,文庫構建,文庫純化,文庫定量,文庫混合、測序以及結果分析的過程,完成一個批次的檢測至少需要 3~4 天,此外,在文庫構建和文庫定量中,會涉及到 PCR 擴增過程。
因此,如實驗室開展高通量測序 NIPT 的日常檢測,需為臨床基因擴增實驗室,具有一定的核酸檢測的基礎,選擇合適的檢測平臺,并進行性能驗證,具備經過嚴格培訓的高素質實驗人員,建立實驗室檢測的標準操作程序,在每批次的檢測中需使用陰性質控和弱陽性質控,參加室間質量評價。
具體來說,在本次質評中,部分實驗室僅有兩個不同的區域,不符合臨床基因擴增實驗室的設置要求;在選擇檢測平臺時,醫院臨床實驗室不建議采用實驗室自用方法 (LDT),因為LDT 首先需要建立自配試劑的標準操作程序,然后還需對檢測系統(包括檢測儀器、試劑以及生物信息學算法)進行性能評價,給出重復性、分析敏感性、分析特異性、臨床敏感性、臨床特異性、陽性預測值以及陰性預測值等等性能指標,而目前來說,對于單個臨床實驗室,要完成 NIPT 的性能評價是非常困難的;實驗室需建立標準操作程序,并需考慮到開展大量樣本檢測后,出現文庫構建失敗、檢測過程操作錯誤、QC 未通過以及“灰區”樣本需復檢等情況,以及針對此情況,評價可能對檢測流程和報告時間產生的影響;在當前的實驗室環境條件下,儀器設備經過一定時間的運行后,是否仍能夠保持良好的性能,能否保持原有的 QC未通過率以及檢測失敗率;此外,也不排除技術快速的發展,新的檢測平臺的出現,或者在原有檢測平臺上的進一步更新,導致現有的檢測平臺可能面臨更新或淘汰。
臨床實驗室需明確,基于高通量測序的 NIPT,只是一種篩查試驗,而不是診斷試驗,遺傳咨詢和進一步的檢測非常重要。并且由于檢測原理是基于外周血游離 DNA,因此具有一定的檢測局限性,例如母體嵌合、胎盤嵌合、雙胎、外周血胎兒游離 DNA 比例低等均會對結果產生影響。
總結:無創產前檢測離規范使用又近了一步
不管怎樣,衛計委發布室間質評,就已預示著這項技術成熟、臨床應用急需的檢測離規范使用又近了一步,而2014年率先通過室間質評的技術平臺,例如上文提到的華大基因、達安基因、貝瑞和康、博奧生物等公司,無疑將在后續競爭中獲得合作終端和客戶更多的信任。(轉化醫學網360zhyx.com)
附:衛生部臨床檢驗中心2015年全國外周血胎兒染色體非整倍體(T21、T18和T13)高通量測序檢測室間質量評價通知
衛檢中字[2014]第04號
各參評單位實驗室:
室間質量評價(以下簡稱“室間質評”)是臨床實驗室保證和改進檢驗質量的重要手段,也是醫療機構臨床實驗室行政管理和實驗室認可的基本要求。新一代高通量測序技術發展迅速,并已由實驗室研究進入到臨床檢測應用,如外周血胎兒染色體非整倍體(T21、T18和T13)檢測、胚胎植入前遺傳學診斷(PGD和胚胎植入前遺傳學篩查(PGS)等,其中外周血胎兒染色體非整倍體(T21、T18和T13)檢測目前已有國家食品藥品監督管理總局(CFDA)批準的儀器和試劑。為提高實驗室外周血胎兒染色體非整倍體(T21、T18和T13)高通量測序檢測的質量,衛生部臨床檢驗中心于2015年度正式開展全國外周血胎兒染色體非整倍體(T21、T18和T13)高通量測序檢測室間質量評價,現將有關事項通知如下。
一、一般情況
1. 臨檢中心2015年外周血胎兒染色體非整倍體(T21、T18和T13)高通量測序檢測室間質量評價計劃相關信息見附錄1。
2. 臨檢中心室間質評信息處理采用基于互聯網的室間質評信息系統,室間質評申請、檢驗結果與相關信息回報、統計分析圖表獲取等通過信息系統完成。室間質評信息系統運行網站為檢驗醫學信息網(http://www.clinet.com.cn),信息系統及其使用說明參見網站相關介紹。計劃書內容及本通知涉及各種技術文件也可在網站獲取。
3. 臨檢中心向參評實驗室收取室間質評費用,用以維持室間質評計劃運行。臨檢中心室間質評收費依據《國家發展改革委辦公廳關于衛生部臨床檢驗室間質量評價等收費問題的復函》(發改辦價格[2003]1066號)。
二、申請
1. 2015年外周血胎兒染色體非整倍體(T21、T18和T13)高通量測序室間質量評價申請日期為自2015年1月1日至2015年1月31日,各參評實驗室應在截止日期前提出申請。
2. 原參加過臨檢中心質評的單位直接網上申請,用本單位用戶名和密碼登錄檢驗醫學信息網(http://www.clinet.com.cn),完整填寫“衛生部臨床檢驗中心2015年臨床檢驗室間質量評價申請表”(一)和(二)(見附錄2);2015年新參評單位需將完整申請表(一)和(二)通過電子郵件或傳真發送臨檢中心,發送后電話聯系臨檢中心(聯系方式見本通知第四項),以確認收到申請,同時獲取實驗室編碼及室間質評信息系統登錄信息。
3. 提交申請表后,按規定時間交納室間質評費用。請將室間質評費用統一匯款至:
戶 名:衛生部臨床檢驗中心
開戶銀行:中國工商銀行北京崇文門外大街支行
帳 號:0200000509014494542
聯 系 人:李靜
聯系電話:(010)5811-5052
請務必先申請,確認申請成功后再進行匯款。
三、質控品接收、檢測及統計結果和質評報告獲取有關詳細情況將在第一次質評樣本寄出時告知。本年度質評郵寄樣本的費用,采用到付的形式,即郵寄的費用由參評單位承擔,特此說明。
四、聯系方式
實驗室遇有室間質評有關的任何問題,請與臨檢中心室間質評室聯系,聯系方式如下:
電話:(010)5811-5055、5811-5065、6527-3025
傳真:(010)6527-3025
電子郵箱:EQA@nccl.org.cn
聯 系 人:王薇 何法霖 鐘堃 趙彥 李國華
衛生部臨床檢驗中心
2014年12月15日